
Оглавление:
- Автор Miles Stephen [email protected].
- Public 2023-12-15 23:40.
- Последнее изменение 2025-01-22 17:09.
Вывод уравнения Хендерсона-Хассельбаха
- Возьмем реакцию ионизации слабой кислоты (НА):
- Константа диссоциации Ka указанной выше реакции будет:
- Затем из уравнение (2) возьмите [H?] Влево (решите, как H?):
- Замените pH и pKa в уравнение (4):
Точно так же, что такое уравнение Хендерсона в химии?
Обновлено 10 августа 2019 г. Хендерсон Hasselbalch уравнение приблизительный уравнение который показывает взаимосвязь между pH или pOH раствора и pKа или pKб и соотношение концентраций диссоциированных химический разновидность.
Аналогичным образом, что означает pKa? Ключевые выводы: pKa Определение В pKa значение - это один из методов, используемых для указывать сила кислоты. pKa - отрицательный логарифм константы диссоциации кислоты или значение Ka. Более низкий pKa значение указывает на более сильную кислоту. То есть более низкое значение указывает на то, что кислота более полно диссоциирует в воде.
Учитывая это, что такое формула pKa?
pKa определяется как -log10 Kа где Kа = [H+] [A-] / [HA]. Из этих выражений можно вывести выражение Хендерсона-Хассельбаха. уравнение который. pKa = pH + log [HA] / [A-] Это говорит нам о том, что когда pH = pKа затем войдите в [HA] / [A-] = 0, следовательно [HA] = [A-] т.е. равное количество двух форм.
Вода - буфер?
Воды это буфер хотя и плохой. Это связано с тем, что H2O само ионизируется с образованием H30 + и OH-. Чтобы образовался кислый буферный буфер вам нужна слабая кислота с сопряженным основанием. Поскольку будут присутствовать ионы гидроксония и гидроксида, да, он действует как буфер но это ужасно.
Рекомендуемые:
Как доказать закон больших чисел?

ВИДЕО Также знаете, как вы объясните закон больших чисел? В закон больших чисел заявляет, что наблюдаемое среднее значение выборки из большой выборка будет близка к истинному среднему значению по совокупности и тем ближе, чем больше будет выборка.
Как доказать преемственность?

Определение: функция f непрерывна в точке x0 в своей области определения, если для любого ϵ> 0 существует δ > 0 такой, что всякий раз, когда x находится в области определения f и | x − x0 | <δ, имеем | f (x) − f (x0) | <ϵ. Мы снова говорим, что f непрерывна, если она непрерывна в каждой точке своей области определения
Как доказать, что что-то является основой?

ВИДЕО И спросил, что составляет основу? В математике набор B элементов (векторов) в векторном пространстве V называется основа , если каждый элемент из V можно однозначно записать как (конечную) линейную комбинацию элементов из B. основа называются основа векторы.
Как вы можете доказать, что 2 треугольника похожи, используя постулат подобия SAS бокового угла?
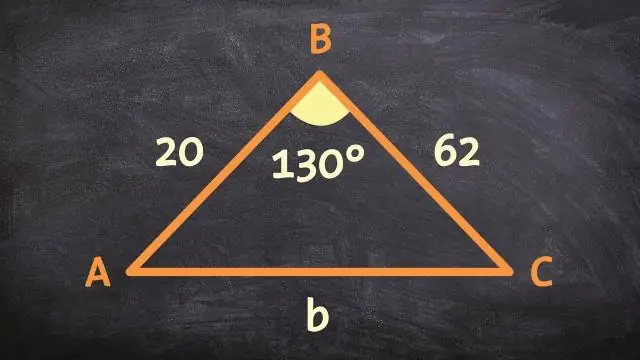
Теорема подобия SAS гласит, что если две стороны в одном треугольнике пропорциональны двум сторонам другого треугольника и угол наклона обоих конгруэнтен, то эти два треугольника подобны. Преобразование подобия - это одно или несколько жестких преобразований, за которыми следует расширение
Как доказать, что сумма внешних углов треугольника равна 360?

Внешний угол треугольника равен сумме противоположных внутренних углов. Подробнее об этом см. Теорема о внешнем угле треугольника. Если эквивалентный угол берется в каждой вершине, внешние углы всегда складываются в 360 °. Фактически, это верно для любого выпуклого многоугольника, а не только для треугольников
